역사
식품의약품안전처(이하 식약처)는 전주기적 의약품 안전관리를 위해 의약품 품목허가 신청 시 위해성 관리 계획을 제출 하는 내용을 골자로「의약품 등의 안전에 관한 규칙」을 개정(2014.8)하였으며, 2015년 7월부터 신약 및 희귀의약품을 대상으로 우선 적용하고 새로운 조성(2016.7), 새로운 제형(2017.7), 새로운 효능·효과 추가 전문의약품(2018.7) 등으로 점차 확대 적용하였습니다.
대상 의약품
- 신약
- 희귀의약품
- 시판 후 중대한 부작용 발생으로 인해 위해성 관리 계획의 제출이 필요하다고 식품의약품안전처장이 인정하는 의약품
- 신청인이 위해성 관리 계획의 제출이 필요하다고 인정하는 의약품
- 「의약품 등의 안전에 관한 규칙」제22조에 따라 재심사대상 의약품으로 지정되는다음 각 목의 의약품 이미 허가된 의약품과 유효성분의 종류 또는 배합비율이 다른 전문의약품․이미 허가된 의약품과 유효성분은 동일하나 투여경로가 다른 전문의약품 이미 허가된 의약품과 유효성분 및 투여경로는 동일하나 명백하게 다른 효능‧ 효과를 추가한 전문의약품
※ 품목허가권자가 이미 품목허가·신고된 바 있는 품목과 유효성분의 종류, 규격 및 분량(액상제제의 경우 농도), 제형, 효능·효과, 용법·용량이 동일한 의약품(이하, 제네릭)을 허가받고자 할 떄 다음의 경우에는 위해성 관리계획을 제출할 수 있다. ․원개발 의약품이 위해성 관리계획을 제출해야 하는 의약품으로서 추가적인 위해성 완화조치를 수행하고 있는 안전성 중점검토항목이 있는 경우 ․시판 후 중대한 부작용 발생으로 인해 위해성 관리 계획의 제출이 필요하다고 식약처장이 인정하는 의약품의 경우(예, 이소트레티노인, 알리트레티노인, 아시트레틴, 탈리도마이드, 레날리도마이드, 발프로산 등)
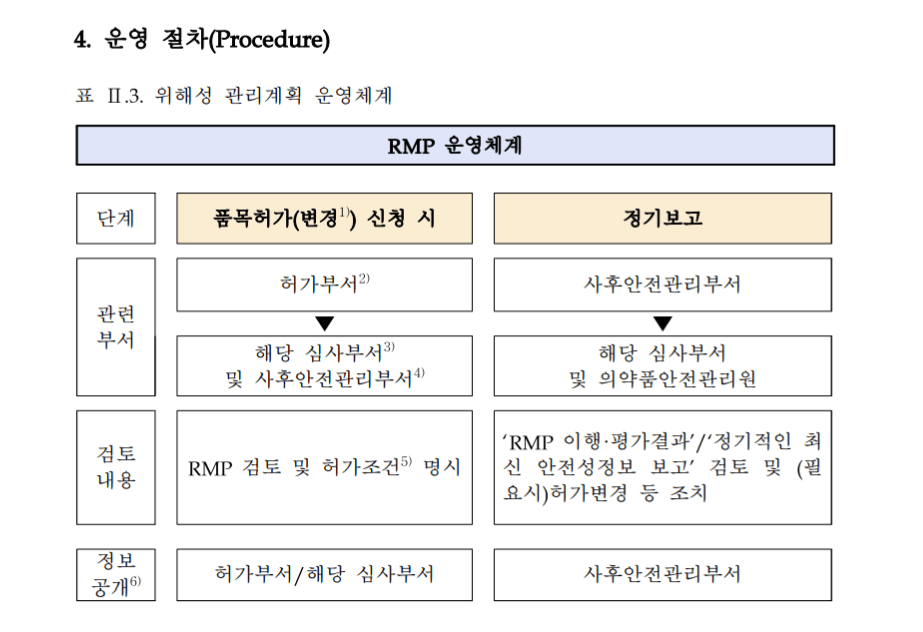
구성
안정성 중점 검토항목
→ 의약품 안전성 프로파일에 대한 적절한 정보를 제공하고, 중요한 규명된 위해성, 중요한 잠재적 위해성, 부족 정보에 초점.
비임상/임상에서의 안전성 요약
지속 검토 필요한 중요 안전성 검토항목
유효성 중점 검토항목
(필요 시)
의약품 감시계획
일반적인 의약품 감시활동
능동적인 감시 또는 비교관찰 연구
그 외 의약품감시계획 (필요 시)
위해성 완화 조치방법
첨부문서(안)
환자용 사용설명서 (필요 시)
의약사등 전문가용 설명자료 (필요 시)
안전사용보장조치 (필요 시)
예
제출 자료 목록
PMS protocol
PMS_분기별_시판 후 조사 정기보고서(별지2호)
PMS_분기별_이상사례보고표
위해성관리계획 정기이행평가결과보고서
분기별_정기적인 최신 안전성 정보 보고서(PBRER)
(제출 목록은 제품, 변경사항에 따라 상이할 수 있습니다.)
위해성 관리 계획(RMP) 대상 의약품은 시판 후 수집된 안전성 정보 등을 분석·평가한 결과를 허가 일로부터 2년간은 6개월 주기로, 그 이후에는 1년 주기로 식약처에 보고하도록 일괄 운영했다. (변경 예정)






